در یک مطالعه جدید گزارش شده، یک درمان آزمایشی آنتی بادی تا حد زیادی از بیماری پیوند حاد گوارشی در مقابل میزبان (GI-aGVHD) در روده موشها و پستانداران غیرانسان (NHPs) که پیوند مغز استخوان – پیوند سلولهای خونساز آلوژنیک (allo-HCT) انجام شده بود، جلوگیری کرد. ) – اما بدون ایجاد سرکوب گسترده سیستم ایمنی. این مطالعه که توسط محققان Penn Medicine و مرکز سرطان و اختلالات خونی کودکان Dana-Farber/Boston انجام شد، نشان داد که مسدود شدن آنتیبادی مسیر سیگنالینگ Notch، بقای پس از پیوند را بهبود میبخشد و به ویژه در برابر GVHD دستگاه گوارش محافظت میکند. این مطالعه بر اساس کار قبلی روی موشها انجام میشود که پتانسیل انتقالی این درمان را برجسته میکند و برخی از مکانیسمهای پشت اثرات آن را رفع میکند. نتایج می تواند راه را برای آزمایش های بالینی انسانی هموار کند.
ایوان میلارد، MD، PhD، گفت: «ما دریافتیم که فقط یک دوز آنتی بادی برای مسدود کردن مسیر سیگنالینگ Notch، که بلافاصله قبل از پیوند داده شد، میتواند از GVHD دستگاه گوارش جلوگیری کند، بدون اینکه عملکرد ایمنی در بقیه بدن را مختل کند. استاد پزشکی و معاون تحقیقات هماتولوژی-آنکولوژی در دانشکده پزشکی پرلمن در دانشگاه پنسیلوانیا. “زمان بسیار مهم بود. مداخله قبل از ظاهر شدن هر گونه علائم GVHD، محافظت طولانی مدت را ممکن کرد.
Maillard یکی از نویسندگان ارشد و همکار مقاله منتشر شده تیم در پزشکی ترجمه علوم، که عنوان آن “Signaling Notch باعث ایجاد بیماری پیوند روده در مقابل میزبان در موش ها و نخستی های غیر انسانی می شود.”
نویسندگان نوشتند، پیوند سلول های خونساز آلوژنیک (allo-HCT) پتانسیل نجاتی برای بیماران مبتلا به بدخیمی های خونی و اختلالات مغز استخوان دارد. با این حال، بیماری حاد پیوند در مقابل میزبان (aGVHD) می تواند به طور بالقوه در گیرندگان کشنده باشد. تیم تحقیقاتی خاطرنشان کرد: «در میان تظاهرات aGVHD، درگیری گوارشی (GI-aGVHD) چالش برانگیزترین است، تقریباً در همه موارد aGVHD شدید به طور برجسته دستگاه گوارش (GI) را درگیر می کند. و حتی زمانی که پیوند مغز استخوان برای سرطان خون یا لنفوم درمان میشود، GVHD – که در آن سلولهای T در پیوند دهنده به بافتهای گیرنده حمله میکنند – همچنان میتواند کشنده باشد. این بیماری یکی از دلایل اصلی مرگ و میر و پیامدهای نامطلوب طولانی مدت سلامت مرتبط با پیوند مغز استخوان است.
میلارد، همراه با نویسنده ارشد و همکار، Leslie S. Kean، MD، PhD، استاد اطفال در دانشکده پزشکی هاروارد و مدیر پیوند سلول های بنیادی کودکان در مرکز سرطان و اختلالات خونی کودکان دانا-فاربر/بوستون، و نویسنده اصلی دکتر ویکتور تکاچف، استادیار جراحی در ماس جنرال بریگهام، مدتهاست که به دنبال جلوگیری از این عارضه کشنده بوده است.
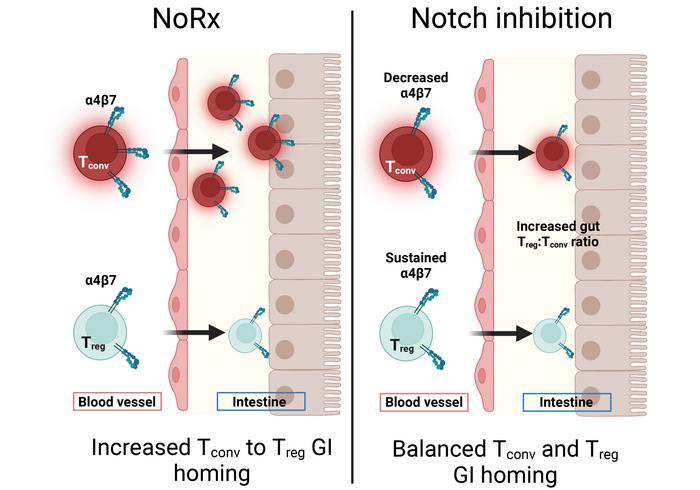
در مطالعات قبلی، Maillard و همکاران دریافتند که فعالیت ایجاد کننده GVHD سلول های ایمنی دهنده – به ویژه سلول های T- به مسیر سیگنالینگ Notch نیاز دارد. در آزمایشهایی با مدلهای موش GVHD، محققان نشان دادند که مسدود کردن یک فعال کننده Notch خاص به نام DLL4 به طور موثری از GVHD در روزهای اول پس از پیوند جلوگیری میکند. این استراتژی از نفوذ و حمله سلولهای T اهداکننده به رودهها، که محل اصلی GVHD شدید است، جلوگیری کرد، اما تواناییهای سلولهای T در مبارزه با عفونت و سرطان را مسدود نکرد.
تا به امروز، مطالعات پیش بالینی به شدت بر روی مدلهای allo-HCT موش تکیه کردهاند، اما این مدلها همیشه ایدهآل نیستند و همانطور که تیم اشاره کرد، «… موش allo-HCT از نظر تهویه پیوند، مراقبتهای حمایتی با allo-HCT انسانی متفاوت است. و عوارض.» برای مطالعه جدید گزارش شده خود، میلارد و آزمایشگاهش با Tkachev، Kean و همکارانش همکاری کردند تا استراتژی ضد DLL4 را با استفاده از آنتی بادی به نام REGN421 در مدل حیوانی بزرگ GVHD آزمایش کنند، که محققان بوستون برای شبیه سازی بهتر سیستم ایمنی انسان توسعه دادند. و اثرات درمان GVHD، و اجازه دادن به آنها برای آزمایش اثرات هدف قرار دادن یک مسیر واحد.
آنها نوشتند: «ما یک مدل allo-HCT هاپلودیکال پر از سلول T از aGVHD را در پستانداران غیرانسانی ایجاد کردیم. در این مدل، درمانها را میتوان در ابتدا بهعنوان عوامل منفرد برای فعالیت آنها در پیشگیری از GVHD ارزیابی کرد، برخلاف بیماران انسانی، که در آن مداخلات جدید باید با داروهایی که برای پیشگیری از GVHD معمول استفاده میشوند ترکیب شوند.
این تیم تأیید کرد که دخالت مسیر Notch در GVHD در بین گونهها حفظ شده است و در مدلهای حیوانی خود نشان دادند که فقط یک دوز از آنتیبادی مسدودکننده DLL4 که بلافاصله قبل از پیوند سلولهای بنیادی داده میشود، بقا را به شدت افزایش میدهد و از علائم GVHD در رودهها جلوگیری میکند. اما بدون ایجاد سرکوب سیستم ایمنی جهانی.
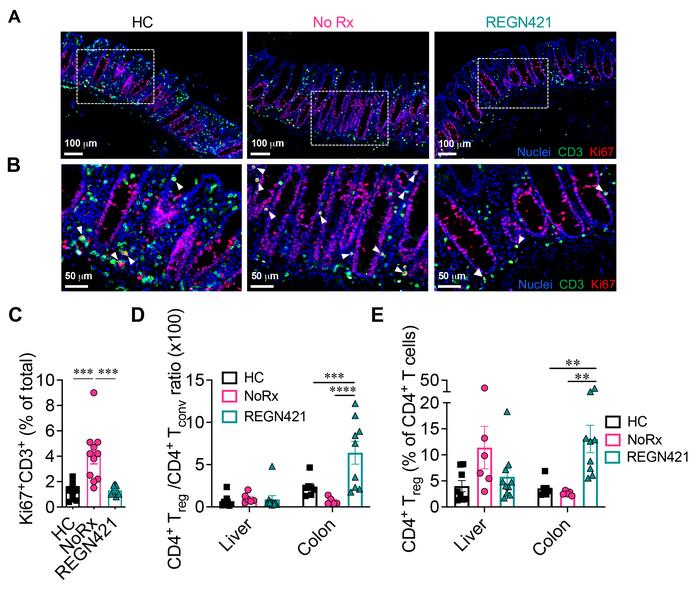
تیم تحقیقاتی همچنین مشاهده کردند که آنتی بادی تعداد سلولهای T معمولی را در روده کاهش میدهد که منجر به نسبت بالاتر سلولهای تنظیمکننده T سرکوبکننده به سلولهای T معمولی میشود. آنها حفاظت خاص آنتی بادی های ضد DLL4 در برابر GVHD دستگاه گوارش را در کاهش مولکول چسبندگی که به طور معمول باعث مهاجرت سلول های T به روده می شود، ردیابی کردند.
محققین اشاره کردند که مهمتر از همه، مهار DLL4/Notch از موشها و NHPها در برابر GI-aGVHD از طریق “مکانیسمهای منحصربهفرد” که با دیگر مهارکنندههای جهانی فعالسازی سلول T متفاوت است، محافظت میکند. “به جای سرکوب سیستم ایمنی جهانی، مهار DLL4/Notch حفاظت خاصی را در برابر GI-aGVHD ارائه کرد، اثری که با سایر عوامل منفرد آزمایش شده برای پیشگیری از aGVHD در NHPها مشاهده نشد.”
به گفته محققان، آزمایش موفقیت آمیز در چندین مدل پیش بالینی راه را برای آزمایشات بالینی اولیه باز می کند که اکنون در Penn Medicine و Dana Farber/Boston Children’s برنامه ریزی شده است. کین اظهار داشت: «اگر این استراتژی جدید و هدفمندتر برای پیشگیری از GVHD در آزمایشهای بالینی موفقیتآمیز باشد، ممکن است به ما این امکان را بدهد که استفاده از پیوند مغز استخوان را به بیماران با ریسک بالاتری که در حال حاضر واجد شرایط پیوند سنتی نیستند، گسترش دهیم. این رویکرد منحصربهفرد میتواند به ما اجازه دهد تا بین اثربخشی و جنبههای منفی سرکوب سیستم ایمنی جهانی ناشی از سایر درمانهای GVHD ارتباط برقرار کنیم.»
با اشاره به محدودیتهای مطالعه پیش بالینی در گزارش خود، تیم نتیجهگیری کرد: «عملاً، فعالیت منحصربهفرد REGN421 در NHPs، محاصره DLL4 را به عنوان یک استراتژی ارزشمند برای توسعه برای پیشگیری از GI-aGVHD در بیماران معرفی میکند، به ویژه به این دلیل که پیشبینی میشود که فعالیتی بر روی یک برنامه پاتوژنی برای بازگشت به روده داشته باشد که سایر مداخلات آن را خنثی نمیکنند. استراتژیهای احتمالی آینده شامل ترکیبی از مهارکنندههای DLL4 با سایر عوامل برای کاهش aGVHD در مکانهای غیر رودهای است.